Molekulare Modellierung von Transport- und Transferprozessen

Das Helmholtz-Institut Münster bildet ein interdisziplinäres Team für theoretische Untersuchungen auf dem Gebiet der Elektrolytforschung. In Kooperation mit dem Institut für physikalische Chemie der WWU beschäftigt sich Dr. Diddo Diddens vom HI MS in seinem Habilitationsprojekt mit der molekularen Modellierung von Ionentransport- und Elektronentransferprozessen in Energiematerialien, insbesondere im Hinblick auf Batterien.
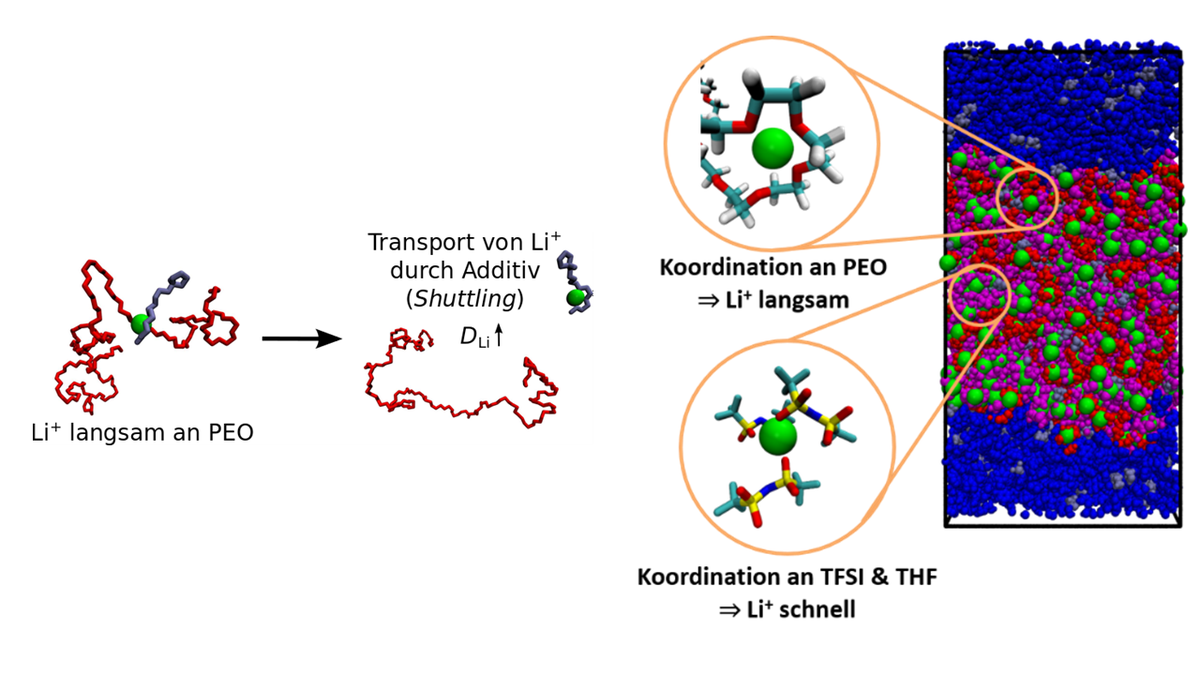
Ionentransport in Polymerelektrolyten
Polymerelektrolyte sind aufgrund ihrer mechanischen Festigkeit und ihrer geringen Entflammbarkeit vielversprechende Alternativen zu flüssigen Elektrolyten, insbesondere für die Anwendung in Lithium-Metall-Batterien. Allerdings ist in vielen dieser Materialien der Lithiumionentransport für technologische Anwendungen so gering, dass weitere Optimierungen notwendig sind. Mittels Molekulardynamik-(MD)-Simulationen möchte Diddens ein grundlegendes Verständnis der molekularen Ionentransportmechanismen erlangen und deren Relevanz für experimentell gemessene Transporteigenschaften bestimmen. Die Arbeiten werden in Kooperation mit der Theorie-Gruppe von Prof. Dr. Andreas Heuer durchgeführt.
Auf der Basis eines mathematischen Modells konnte gezeigt werden, dass der Einsatz von niedermolekularen Additiven, die die Lithiumionen direkt koordinieren und von den langsamen Polymerketten entkoppeln, den Diffusionskoeffizienten der Lithiumionen deutlich erhöhen kann (1; siehe linkes Bild in Abbildung 1). Eine ähnliche Entkopplung der Lithiumionen von der koordinierenden Polymermatrix kann für Blockcopolymere beobachtet werden, die mit großen Mengen an Lithiumsalz dotiert sind (2; rechtes Bild in Abbildung 1), analog zu Polymer-in-Salz-Elektrolyten (3).
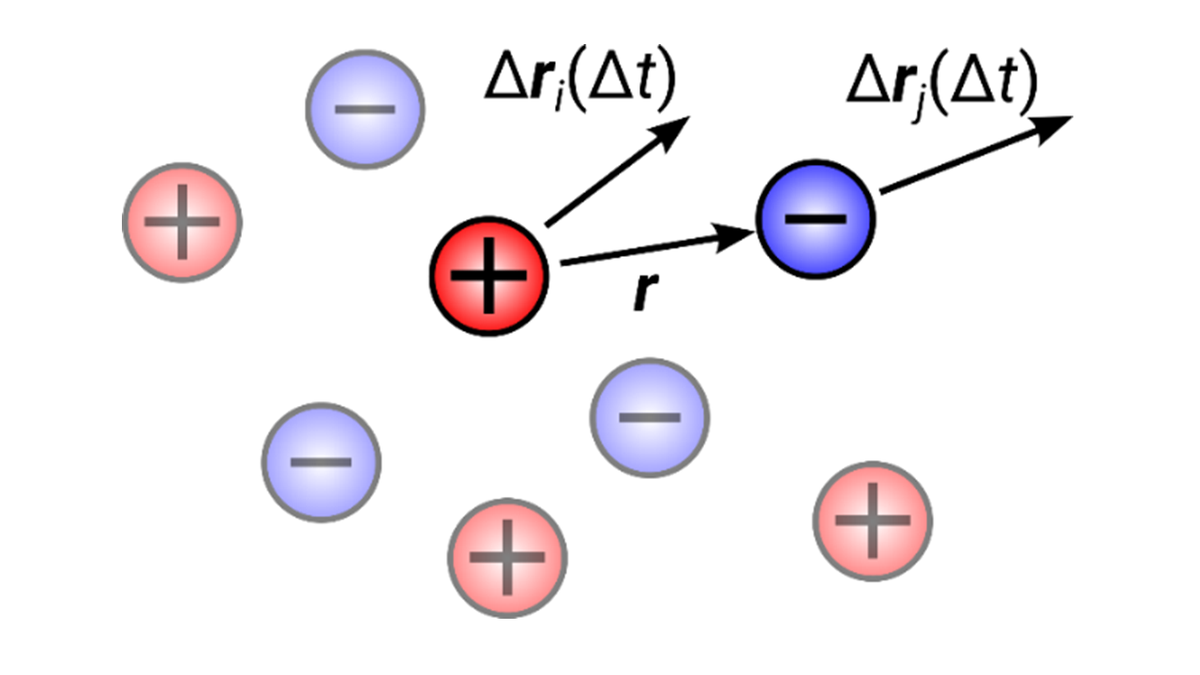
Verständnis dynamischer Ionenkorrelationen
Für Batterieelektrolyte ist der von einer gegebenen Ionensorte, beispielsweise Lithiumionen, getragene Strom ein wichtiger Transportparameter, der üblicherweise durch das Produkt zweier Größen ausgedrückt wird: die Gesamtleitfähigkeit und die Überführungszahl. Während Diffusionskoeffizienten – die die Bewegung einzelner Ionen charakterisieren – separat für Kationen und Anionen (und Lösungsmittelmoleküle) gemessen werden können, ist die Bestimmung des Anteils des Stroms, der von einer bestimmten Ionenspezies getragen wird, weniger trivial. Das liegt daran, dass sich Ionen kooperativ bewegen, was üblicherweise durch die Bewegung von Ionenpaaren oder Clustern (siehe Schema in Abbildung 2) veranschaulicht wird, sodass die gesamte transportierte Ladung von den nominellen Ladungen der Ionen abweicht. Mittels MD-Simulationen möchte Diddens die dynamischen Ionenkorrelationen genauer verstehen (4).
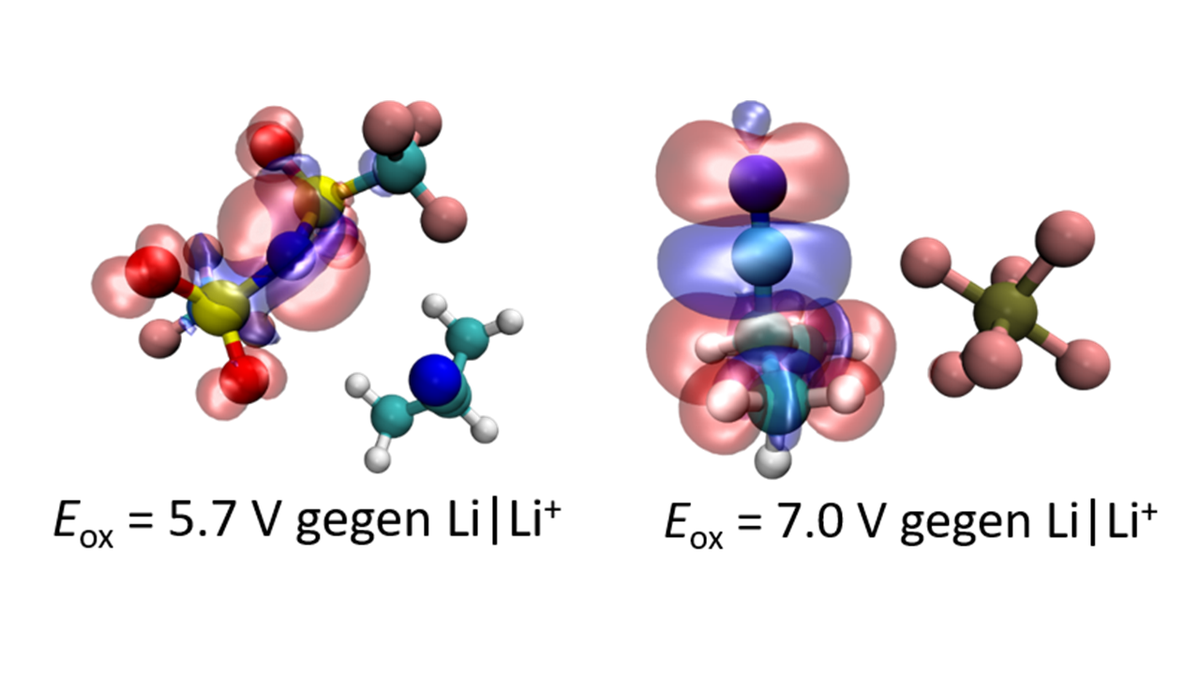
Elektrochemische Stabilität und Zersetzung von Elektrolyten
Typische Batterieelektrolyte sind sowohl gegenüber metallischem Lithium als auch gegenüber Graphit- bzw. Siliziumanoden mit interkaliertem Lithium thermodynamisch instabil. Eine fortschreitende Elektrolytzersetzung kann jedoch verhindert werden, wenn sich eine Passivierungsschicht, die sogenannte Solid Electrolyte Interphase (SEI), bildet, die den Elektrolyten kinetisch stabilisiert. Ähnliche Überlegungen gelten für die Kathodengrenzfläche, insbesondere bei Hochvoltanwendungen, die eine analoge Cathode Electrolyte Interphase (CEI) erfordern.
In der Praxis kann die Bildung dieser Passivierungsschichten mit Hilfe von Additiven erreicht werden, jedoch sind in vielen Fällen die genauen Zersetzungsmechanismen unbekannt, was die gezielte Verbesserung dieser Additive erschwert. Mit Hilfe quantenchemischer Berechnungen strebt Diddens an, die von seinen Kollegen im Experiment beobachteten Redoxstabilitäten nachzuvollziehen, indem er mögliche Zersetzungsreaktionen (5; 6; 7) oder den Einfluss verschiedener Ionen bzw. Lösungsmittel (8; 9) explizit berücksichtigt (Abbildung 3). Auf diese Weise kann eine quantitative Übereinstimmung der Brechnungen mit den experimentellen Daten erreicht werden.
Publikationen:
1) Journal of The Electrochemical Society 2017, 164(11), DOI: 10.1149/2.0271711jes
3) Solid State Ionics 2020, 357, 115497, DOI: 10.1016/j.ssi.2020.115497
4) Physical Chemistry Chemical Physics 2018, 20(24), 16579-16591, DOI: 10.1039/C8CP01485J
5) Journal of Power Sources 2020, 461, 228159, DOI: 10.1016/j.jpowsour.2020.228159
6) ChemElectroChem 2020, 7(6), 1499-1508, DOI: 10.1002/celc.202000386
7) Applied Materials & Interfaces 2019, 11(18), 16605-16618, DOI: 10.1021/acsami.9b03359
8) Journal of Power Sources 2020, 478, 229047, DOI: 10.1016/j.jpowsour.2020.229047
9) Journal of Chemical Physics 2020, 152(17), 174701, DOI: 10.1063/5.0003098
