Automatisierte Synthese von PET-Tracern
Das stetig wachsende klinische Interesse an molekularen Bildgebungsverfahren wie der Positronen-Emissions-Tomographie (PET) führt zu einem ebenfalls steigenden Bedarf an neuen, einfach reproduzierbaren und vor allem mit sehr hohen Mengen an Radioaktivität (> 50 GBq) durchführbaren, Syntheseverfahren zur Herstellung von b+-Emitter tragenden radioaktiven Arzneimitteln (PET-Tracer). Gleichzeitig müssen diese Syntheseverfahren in ihrer Gesamtheit den hohen Ansprüchen und Forderungen nach „Guter Herstellungspraxis“ (GMP) genügen. Um sowohl den behördlichen Regularien, insbesondere in Bezug auf Sterilität und Reinheit der Produkte, als auch dem Schutz der herstellenden Operateure vor ionisierender Strahlung Rechnung zu tragen, erfolgt die Synthese der Radiopharmaka mit Hilfe von, in bleiabgeschirmten Zellen (sog. Hot Cells) befindlichen, Synthesemodulen. Letzteres setzt natürlich voraus, dass derartige Syntheseprozesse und -apparaturen computergestützt automatisierbar und fernsteuerbar sind. Die derzeit gängigsten, speziell für o.g. Zwecke geeigneten, Modelle können in zwei Hauptkategorien eingeteilt werden: Systeme mit einem festen vordefinierten Schlauchdesign, und Systeme, die sog. Einwegkassetten verwenden.

Je nach Anforderung kann sowohl das eine, als auch das andere von Vor- bzw.- Nachteil sein. Aus diesem Grund werden in der Radiopharmakaproduktion des INM-5 auch beide Systeme verwendet. Während bei den Kassettensystemen auf kommerziell erhältliche Modelle zurückgegriffen wurde, sind diese mit einem festen Design, bis auf wenige Ausnahmen, vollständig inkl. benötigter Software vom INM-5 selbst konstruiert, entwickelt und innerhalb der Werkstätten des FZJ gebaut. Nachfolgende Abbildung zeigt ein Beispiel einer solchen Syntheseapparatur (rechts im Bild) inkl. des dazugehörigen R&I-Fließschemas (links im Bild).

Ablauf einer automatisierten Synthese am Beispiel von [18F]FET
Nach erfolgter Reinigung der Syntheseeinheit, wird diese mit allen für die Herstellung von [18F]FET benötigten Ausgangsstoffen, nach einem zuvor definierten und erstellten Standardarbeitsverfahren (SOP), befüllt. Nach Abschluss aller weiteren Synthesevorbereitungen wird die Bleibox der „heißen Zelle“ manuell geschlossen. Zeitgleich zu den Synthesevorbereitungen wird das benötigte 18F- durch Bestrahlung von ca. 1,5 mL H218O mit 16 MeV Protonenenergie am hauseigenen Babyzyklotron durch die Kernreaktion18O(p,n)18F hergestellt. [18F]Fluorid wird anschließend mittels eines Heliumstromes in die Syntheseapparatur transportiert.
Synthese von O-(2-[18F]Fluorethyl)-l-tyrosin
Nach dem Synthesestart wird [18F]Fluorid zunächst auf einem Anionenaustauscher fixiert, nachfolgend mit einer wässrigen K2CO3-Lösung eluiert und in den Reaktor der Syntheseapparatur geleitet. Das so erhaltene Fluorid-Ion ist in Folge seines hohen Solvatationsgrades, bedingt durch seine hohe Ladungsdichte, ein schwaches Nucleophil. Um die Reaktivität von 18F- soweit zu steigern, dass nucleophile Substitutionen möglich werden, müssen sogenannte Phasentransferkatalysatoren (z.B.: Kryptofix-2.2.2) zugesetzt und Wasser entfernt werden.
Zur Entfernung des Wassers wird die Lösung nach Zugabe von Acetonitril mehrfach azeotrop destilliert.
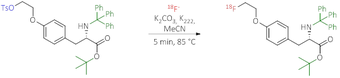
Durch Zugabe von Triphenylmethylamino-3-(4-(2-(toluen-4-sulfonyloxy)ethoxy)phenyl)propionsäure-tert-butylester wird, innerhalb von 5 min bei 85 °C, zunächst eine geschützte Vorstufe des gewünschten Produktes erhalten, dass sich anschließend durch Abspaltung der Schutzgruppen (Grün dargestellt), in Anwesenheit von HCl bei 100 °C, in die Rohproduktlösung von [18F]FET überführen lässt.

Chromatographische Reinigung und Abfüllung
Nach der Schutzgruppenabspaltung wird die Rohproduktlösung auf Raumtemperatur abgekühlt, mit wässriger Natronlauge neutralisiert und mittels präparativer HPLC gereinigt.
Anschließend wird die produkthaltige Fraktion in ein Sammelgefäß geleitet, die finale Aktivität und das Volumen ermittelt und über einen sterilen Membranfilter mithilfe der automatischen Abfüllung in sterile Ampullen überführt. Das hergestellte Produkt wird i.d.R. in vier Portionen geteilt (Qualitätskontrollprobe, Patientenprobe, Steriltestprobe, Rückstellprobe). Steriltest- und Rückstellprobe werden zunächst im Abklingtresor untergebracht und später weiter verarbeitet. Die Patientenprobe wird vom Strahlenschutzbeauftragten in einer geeigneten Transportbox verpackt, mit einer Plombe versiegelt und zum vorbestimmten Empfänger verschickt.
Qualitätskontrolle und Freigabe der Radiopharmaka am INM-5
Parallel zum Übergabe- und Transportprozess wird die Qualitätskontrollprobe gemäß der Prüfanweisung untersucht. Verschiedene Analysenverfahren kommen hier zum Einsatz. So wird u.a. mittels GC auf Restlösungmittel geprüft, die HPLC gibt Aufschluss über radiochemische und chemische Reinheit und über den Lumulus-Test kann der Gehalt an Endotoxien ermittelt werden.
Die Ergebnisse der durchgeführten Analysen werden in ein Analysenprotokoll übertragen und durch den Leiter der Qualitätskontrolle überprüft. Anschließend werden das Herstellungsprotokoll und das Analysenprotokoll zusammen mit sämtlichen Rohdaten an die sachkundige Person übergeben. Diese führt eine Dokumentenprüfung durch. Werden alle Spezifikationsanforderungen erfüllt und liegen keine qualitätsrelevanten Abweichungen vor, erfolgt die Freigabe zur Anwendung der Produktcharge durch die Unterschrift der sachkundigen Person auf dem Analysenprotokoll.
